La electrolisis del agua es la descomposición de agua (H 2 O) en oxígeno (O 2) y de hidrógeno gas (H 2) debido a una corriente eléctrica que pasa a través del agua.
 Principio
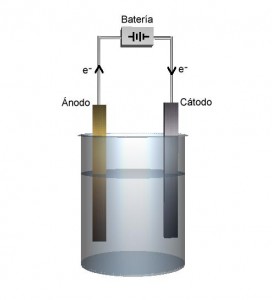
Principio
Una fuente de alimentación eléctrica está conectada a dos electrodos, o dos placas (por lo general hechas de un metal inerte como el platino o acero inoxidable) que se colocan en el agua. En una celda diseñada correctamente, el hidrógeno aparece en el cátodo (el electrodo con carga negativa, donde los electrones entran en el agua), y el oxígeno aparecerá en el ánodo (el electrodo con carga positiva).
La electrolisis del agua pura requiere el exceso de energía en forma de sobre-tensión para superar la activación de diversas barreras. Sin el exceso de energía de la electrólisis del agua pura se produce muy lentamente o nada. Esto se debe en parte a la limitada auto-ionización del agua . El agua pura tiene una conductividad eléctrica cerca de una millonésima de agua de mar. Muchas celdas electrolíticas también pueden carecer de la necesaria electrocatalizadores . La eficacia de la electrólisis se incrementa a través de la adición de un electrolito (tales como sal , un ácido o una base ) y el uso de electrocatalizadores .
Actualmente, el proceso electrolítico es raramente usado en aplicaciones industriales ya que el hidrógeno puede ser producido más asequiblemente gracias a los combustibles fósiles.

No hay comentarios:
Publicar un comentario