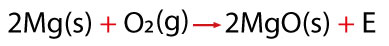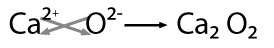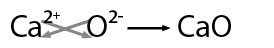Oxigeno sobre los Elementos
Reacciones de oxígeno:
El
oxígeno es un elemento que abunda más en el
planeta Tierra. El oxígeno forma el 50% en masa de la corteza terrestre y el
21% en volumen de la atmósfera, de lo cual es componente activo del aire, se
encuentra presente en el agua y como óxidos con otros elementos. Reacciona
tanto con metales como con no metales, el oxigeno es el segundo no metal de
reactividad química, después del flúor. Existen dos alótropos del elemento, el más
común es la molécula diatómica "O2", el otro es el ozono que es una
molécula triatómica "O3".
Para
presentar la reacción química de un fenómeno, es representado a
través de una ecuación química , que muestra los cambios
que se llevan a cabo la reacción, con esto podemos describir las
variaciones que se realizan cuando se oxidan los elementos metálicos y no
metálicos en
presencia de oxígeno y con el uso de la
energía calorífica.
Reacción con
metales:
Un ejemplo de las reacciones del oxígeno con un metal, es la que ocurre con el magnesio al someterlo a la reacción de oxidación en una flama, pues desprende una intensa luz blanca y se convierte en un sólido blanco muy frágil; el producto de esta reacción es un óxido metálico llamado óxido de magnesio.
A nivel molecular lo que ocurre es lo siguiente:
Reacción con no metales:
Cuando
el oxigeno forma un oxido con un metal, ocurre lo mismo con un no metal. Un
ejemplo de ello es el carbono, cuando éste es sometido a la reacción de
oxidación en la flama, se lleva a cabo una combustión por parte del carbono y
desprende el gas llamado monóxido de carbono. De lo que hablando de la valencia
puede formar diferentes reacciones; en la posibilidad cuando la valencia de
intercambio del carbono es la mayor, forma el dióxido de carbono.
Ejercicio 1:
- Fórmula
de
óxidos
metálicos
Reacciones de óxido con Agua
Con la formación de óxidos ya
sea metálicos como no metálicos, es factible combinarlos con agua para formar
nuevos compuestos. En el caso de los óxidos metálicos cuando están al
contacto con el agua forman hidróxidos. Ahora tomando el caso del
oxido de magnesio en contacto con el agua ocurre una reacción:
En caso que se forme un oxido
no metálico en presencia de agua forman ácidos, que son del tipo oxiácido. Otra caso con respecto a un ácido tipo oxiácido es el dióxido de
carbono o anhídrido carbónico al reaccionar con agua, produce una molécula de
ácido carbónico.
Para dar explicación a
la reacción del ácido sulfúrico matemáticamente sólo
se sumo la cantidad de elementos que intervienen en la
síntesis de los ácidos, empezando por el ácido representado por los hidrógenos,
después el no metal y al final la cantidad de oxígenos que intervienen en
la ecuación para formar ácidos.
Ejercicio 2
Hidróxidos y ácidos
Laboratorio virtual
 |
| Inicio del Laboratorio Virtual |
 |
|



Reglas de Nomenclatura
La nomenclatura química es un conjunto de reglas que se aplican para nombrar y representar con símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico o sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico o tradicional.
- Sistema de nomenclatura Stock.
Óxidos Metálicos
Un
oxido metálico es la reacción que hay entre el oxigeno y
metales y al estar con el agua forma una base. De lo que puede formar:
Nomenclatura Stock
Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó, por ejemplo: óxido de calcio.
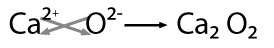
En este ejemplo hay posibilidad de obtener el mínimo común divisor entre los valores por lo que se obtiene: CaO -óxido de calcio-.
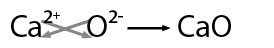
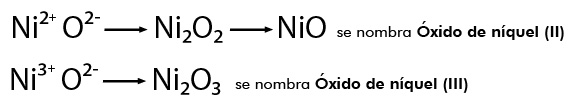
Cuando el metal presenta más de una valencia se nombran con la palabra genérica óxido seguida de la preposición de y después el nombre del metal, escribiendo entre paréntesis con número romano el valor de la valencia, por ejemplo:
Nomenclatura clásica ó tradicional
Estos mismos compuestos se pueden nombrar con la palabra genérica óxido seguida del nombre del metal con el sufijo oso para el valor menor de la valencia y con el sufijo ico cuando el valor de su valencia es mayor, por ejemplo:

Nomenclatura IUPAC
La IUPAC determina que estos compuestos se nombran a partir de la cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel:

Nomenclatura funcional,clásica o tradicional
Los óxidos no metálicos se adjuntan con el agua por síntesis o adición forman su ácido, de lo cual se nombran de nombre de provincia "ácido" de lo cual se conserva sustituyendo el nombre de anhídrido. Para formar los ácidos se parte de su óxido o anhídrido en presencia de agua:
Nomenclatura
ejercicio 3
Balanceo
El balanceo es igualar el número de átomos de cada elemento tanto en los reactivos como en los productos y sirve para verificar La Ley de la Conservación de la Materia (La materia no se crea ni se destruye solo se transforma). Al momento de escribir y balancear una ecuación química de una forma acertada, es necesario tener en cuenta estos puntos:
- Revisa que la ecuación química esté completa y bien correctamente escrita.
Balancear primero los metales, los no metales y por ultimo el oxígeno y el hidrógeno presentes en la ecuación química.
Escribir los números requeridos como coeficiente al inicio de cada compuesto.
Contar el número de átomos multiplicando el coeficiente con los respectivos subíndices de las fórmulas y sumar los átomos que estén de un mismo lado de la ecuación.
Verificar el balanceo final y reajustar si es necesario.
A continuación veremos los pasos a seguir para que realices un balanceo de ecuaciones químicas.
Observa que la ecuación química esté completa y bien escrita.

Ecuaciones, producto y balanceo
Ejercicio 4
 |
| 1 |
Actividades Finales
Bibliografía
Portal Académico de CCH Vallejo ´´Química´´ Unidad 2 Oxígeno sobre elemento.
Aylin Paola PerezPeña García